Tunni ülesehitus
- Sissejuhatus, 7 min
- Ained, aatomid ja molekulid, 5 min
- Vee molekul, 8 min
- Vesi kui lahusti, 8 min
- Kartulikatse lõpetamine, 10 min
- Kokkuvõte, 7 min
Ettevalmistus
- Õpetajal on valmis pandud kartulikatse lõpetamiseks vajalikud vahendid (kuivanud kartulipudi ja toidukaal).
- Õpilastel on kaasas pakk väikeseid värvilisi komme (sobivad näiteks Skittles või M&M’s) ja väike ühevärviline (eelistatult valge) taldrik (või jogurtitopsi kaas, kaalusalati karp vm väike ühevärviline anum).
Eelteadmised
Õpilane teab, et
- vett vajab kogu elusloodus;
- magneti vastaspoolused tõmbuvad ja samasugused poolused tõukuvad.
Eesmärgid
- Õpilane teab, et
- ained koosnevad aatomitest ning aatomid võivad moodustada molekule;
- vee molekul koosneb kahest vesiniku ja ühest hapniku aatomist;
- vesi on väga hea lahusti.
Seotud materjal
- ptk 1.2 „Vesi kui aine. Vee omadused“
- lk 10–13
- I osa lk 6–7
Märksõnad ja meetodid
- aine, molekul, aatom, lahus, lahusti
- katse, liikumisülesanne, rühmatöö, animatsioon
Lõiming
3. kl loodusõpetus
- Elekter ja elektrivool (lk 30–31)
- Magnet ja kompass (lk 36–37)
7. kl loodusõpetus
- Mis on aatom? (lk 50–51)
- Keemilised sidemed (lk 80–81)
- Liht- ja liitained (lk 82–83)
- Ainete segud (lk 106–107)
- Mis on lahus? (lk 108–109)
1. Sissejuhatus
7
- Kommivikerkaare katse
Tunni alguses võiks sissejuhatuseks teha kommivikerkaare katse. Selleks on igal õpilasel vaja värvilisi komme (hästi sobivad Skittles ja M&M’s), ühevärvilist (soovitatavalt valget) taldrikut (või jogurtitopsi kaant, kaalusalati karpi vm ühevärvilist anumat) ja vett. Kui mõnel õpilasel vahendeid pole, võib katset teha ka paaris või rühmas.
Kommid tuleks laduda ringis taldrikule, jättes neile 0,5–1 cm vahet (näidis). Järjestusele ja värvide valikule võivad õpilased loominguliselt läheneda. Ilus tulemus tuleb näiteks siis, kui kasutada kõiki värve komme ja korrata sama värvide järjestust. Kui kommid on paigas, võiks küsida õpilastelt, mis juhtub, kui kommidele vett peale kallata.
Vesi tuleks kallata taldriku keskele ettevaatlikult, nii et kommid paigalt ei nihkuks. Vett peab olema piisavalt, st kõik kommid peaksid ulatuma vähemalt kolmandikuni vette. Vesi võiks olla soe, sest siis on tulemused kiiremad. Õpetaja peaks rõhutama, et taldrikut ei tohi nüüd liigutada. Õpilastele võiks anda ülesande hoolsalt katset jälgida ja kommenteerida, mida nad näevad. See, kelle taldriku keskel värvid kohtuvad, võiks käe tõsta. Külmas vees peaksid värvid taldriku keskel kohtuma umbes nelja minuti pärast, sooja vee puhul kiiremini. Seejärel võiks õpilastelt uurida, mis nende meelest katse käigus juhtus, ja lasta neil selgitada nii, nagu nad oskavad.
Värvide vikerkaar, mida näeme, tekib kommi koostises oleva toiduvärvi lahustumisest vees. Sellest, mida lahustumine tähendab ja kuidas vesi on üldse suuteline midagi sellist tegema, räägime tunni käigus. Kõigepealt on aga paremaks mõistmiseks vaja seletada, mis vesi täpsemalt on ja millest see koosneb.
2. Ained, aatomid ja molekulid
5
- Kõik maailmas koosneb ainetest ja nende segudest
- Igal ainel on iseloomulikud omadused, nt värvus, lõhn ja maitse
- Ained on nt kuld, raud, vesi, suhkur
- Ainete segud on nt merevesi ja õhk
- Animatsioon aatomitest
- Kõik ained koosnevad aatomitest
- Aatomid on kujuteldamatult väikesed
- Ühte tüüpi või erinevad aatomid võivad liitudes moodustada molekuli
- Molekul koosneb vähemalt kahest aatomist
Aine omadused
Kõik asjad ja olendid maailmas koosnevad ainetest ja nende segudest. Ained on näiteks kuld, raud, vesi ja suhkur. Igal ainel on iseloomulikud omadused, mille järgi saab ainet ära tunda ja teistest eristada. Omadused on näiteks värvus, lõhn ja maitse.
Ainete segu
Ainete segu koosneb vähemalt kahe aine osakestest. Kõigile tuttav ainete segu näiteks on merevesi, milles on soolad, hapnik, süsihappegaas ja muud ained veega segunenud. Ainete segu on ka kõikjal meie ümber olev õhk, see sisaldab lämmastikku, hapnikku, süsihappegaasi ja muid gaase. Ainete segud on näiteks ka muld, teras, õunamahl, hambapasta ja huulepulk.
Aatomid ja molekulid
Vaadake animatsiooni aatomitest ja vastake seejärel küsimustele.
Kõik ained koosnevad imetillukestest osakestest, mida nimetatakse aatomiteks. Aatomi suurusest saab aimu, kui kujutada ette, et jalgpall oleks Maa-suurune. Sel juhul oleks üks jalgpalli aatom sama suur kui inimese rusikas. Aatomi suurust võib proovida ette kujutada ka nii, et vaadata üht juuksekarva. Kui aatomid paigutada tihedalt üksteise kõrvale, mahuks neid juuksekarva läbilõikesse lausa miljon tükki. Tohutu hulk! Seega on aatom niivõrd väike, et seda pole võimalik palja silmaga kuidagi näha. Selleks et aatomitest aimu saada, kujutatakse neid kerakujulisena nagu nähtud animatsioonis, ehkki päriselt on aatomi ehitus palju keerulisem. Joonistel või animatsioonides kujutatakse aatomeid sageli ka eri värvidega, et neid oleks lihtsam eristada. Tegelikult pole aga aatomid värvilised.
Molekul on aineosake, mis koosneb vähemalt kahest aatomist. Omavahel võivad liituda nii ühte tüüpi kui ka erinevad aatomid. Tänases tunnis hakkame lähemalt rääkima molekulidest, millest koosneb vesi.
Kas ainult eluta asjad koosnevad aatomitest?
Kuna varem on olnud jutuks, et elusolendid koosnevad rakkudest, mis on väga tillukesed, võib tekkida õpilastes väärarusaam, et elusolendite väikseim osake on rakk ja eluta olenditel on selleks aatom. Kuna nii rakud kui ka molekulid on väga väikesed, on raske nende suurusvahekorda ette kujutada. Tegelikult koosnevad ka kõik elusolendid aatomitest. Iga rakk koosneb molekulidest ja need omakorda aatomitest.
3. Vee molekul
8
- Vee molekul koosneb kahest vesiniku ja ühest hapniku aatomist
- Vee molekulil on osaliselt negatiivne ja osaliselt positiivne laeng
- Laenguga osade tõttu tõmbuvad vee molekulid omavahel
- TV lk 6 ül 2 vee molekulide moodustamine rühmatööna
- TV lk 6 ül 1 (Opiq ptk 1.2 ül 3a, 3b) ja 3
Vee molekul koosneb kahest vesiniku ja ühest hapniku aatomist. Kuju poolest meenutab vee molekul veidi Miki-hiire pead. Vesiniku aatomit tähistatakse H‑tähega, hapniku aatomit O‑tähega, seetõttu tähistavad keemikud vee molekuli H2O (loe: haa-kaks-oo). Vee molekuli see osa, kus on hapniku aatom, on negatiivse laenguga, aga see osa, kus on vesiniku aatomid, on positiivse laenguga (illustratsioonil tähistatud miinuse ja plussiga). Nii nagu magneti vastaspoolused tõmbuvad ja sama märgiga poolused tõukuvad, sama juhtub ka vee molekuliga: ühe molekuli positiivse laenguga piirkond ja teise molekuli negatiivse laenguga piirkond tõmbuvad.
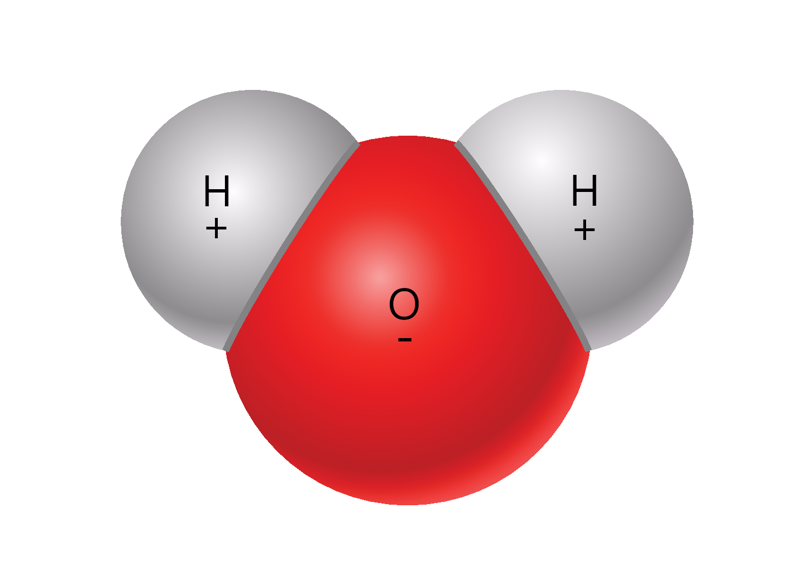
Miks on vee molekuli osadel eri laengud?
Iga aatom koosneb positiivse laenguga tuumast ja selle ümber liikuvatest negatiivse laenguga elektronidest. Kui kaks aatomit satuvad teineteise lähedale, tõmbab ühe aatomi tuum lisaks ka teise aatomi elektrone ja vastupidi. Kui tõmme on piisavalt tugev, võib üks või mitu elektroni hakata liikuma ümber mõlema aatomi tuuma, st aatomid hakkavad neid elektrone jagama. Seejuures ei pruugi see jagamine olla võrdne. Vee molekulis tõmbab hapniku aatom elektrone tugevamalt kui vesiniku aatomid, mistõttu aatomite vahel jagatud elektronid viibivad rohkem hapniku kui vesiniku läheduses. Seetõttu tekivad vee molekulil positiivse ja negatiivse laenguga piirkonnad, ehkki molekul tervikuna on neutraalne, see tähendab laenguta. Vee molekuli positiivse ja negatiivse laenguga osad tõmbuvad aga vastavalt teiste veemolekulide positiivse ja negatiivse laenguga osadega.
Üks vee molekul võib olla seotud kuni nelja naabermolekuliga. Kuna vee molekulid on omavahel seotud, voolab vesi kraanist katkematu joana. Molekulide omavaheline tõmbejõud on ääretult oluline, ilma selleta ei saaks veri meie soontes voolata ega suudaks taimed mullast vett ammutada (sellest tuleb lähemalt juttu kapillaarsuse teema juures).
Õpilased võiksid nüüd püsti tõusta ja läbi teha lk 6 ül 2. Seejärel lahendage lk 6 ül 1 (ptk 1.2 ül 3a, 3b) ja lk 6 ül 3.
4. Vesi kui lahusti
8
- Enamasti on vees lahustunud ka teiste ainete osakesi
- Vesi on maailma parim lahusti
- Animatsioon veest kui lahustist
- Lahus koosneb lahustunud ainest (nt suhkur) ja lahustist (nt vesi)
- Kodus lahustame vees näiteks suhkrut, soola, pesupulbrit
- Vees ei lahustu näiteks kivi, liiv, metall, rasv, õli ja bensiin
Nagu räägitud sai, on puhas vesi värvusetu, läbipaistev, lõhnatu ja maitsetu. Enamasti ei koosne vesi aga ainult vee molekulidest, vaid selles leidub ka teiste ainete osakesi. Seda seetõttu, et vesi on maailma parim lahusti. Vee hea lahustamisvõime tähendab, et kus iganes vesi liigub (läbi õhu, maapinna või nt läbi inimkeha), võtab ta endaga kaasa mineraale, toitaineid ja teisi keemilisi ühendeid. Ilma vee sellise omaduseta poleks elu Maal võimalik.
Vaadake animatsiooni veest kui lahustist ja vastake küsimustele.
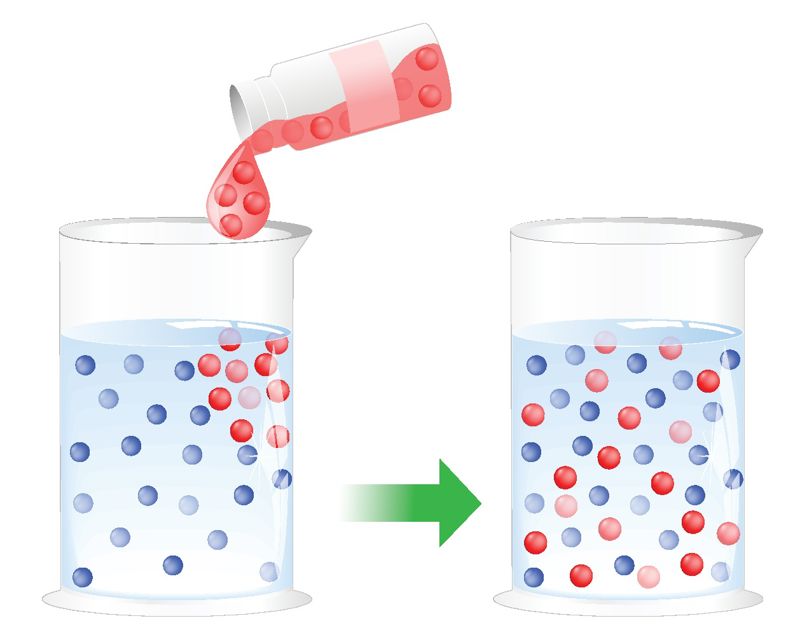
Lahus on ühtlane segu, mis koosneb lahustunud ainest ja lahustist. Kui mõelda tunni alguse katse peale, siis suur osa Skittlesi kommist koosneb suhkrust. Peale selle, et vee molekulid tõmbuvad omavahel, tõmbuvad nad ka paljude teiste ainetega, millel on positiivse ja negatiivse laenguga osad (nt suhkru molekulid). Kui vee molekulid tõmbavad suhkru molekule enda poole tugevamini kui suhkru molekulid üksteisest kinni hoiavad, kisuvad vee molekulid suhkru molekuli teistest suhkru molekulidest lahti ja see ümbritsetakse vee molekulidega. See tähendab, et suhkur lahustub. Ehkki me seda enam ei näe, ei kao suhkur kuhugi, suhkru molekulid lihtsalt jaotuvad vee molekulide vahel laiali. Vee molekulid tõmbavad ka kommis olnud värvaine molekule, mistõttu värvainegi lahustub vees.
Vees võivad lahustuda nii tahked, vedelad kui ka gaasilised ained. Tasub mõelda näiteks merevee peale. See ei ole maitsetu, vaid kergelt soolane. Kes on maitsnud ookeanivett, teab, et see on lausa väga soolane. Nii mere- kui ka ookeanivees on lahustunud soolad. Veekogudes on alati lahustunud ka hapnikku, muidu ei saaks kalad ega muud organismid vees elada. Hapnik satub vette õhust, aga hapnikku eraldavad vette ka veetaimed fotosünteesi käigus. Vees on lahustunud ka süsihappegaasi, mida taimed kasutavad fotosünteesiks.
Lahustega puutume kokku iga päev. Pesu pestes lahustame vees pesupulbrit. Kui on nohu, pritsime ninna apteegis müüdavat soolalahust. Vesivärvidega ei saaks joonistada, kui me neid vees ei lahustaks. Ilma vee lahustamisvõimeta ei saaks me toitu keetes seda maitsestada ei soola ega suhkruga. Ükskõik millisele joogile ka ei mõtleks (nt õunamahlale, morsile või limonaadile), tegu on veega, milles on lahustunud teisi aineid. Morsi korral on vees lahustunud siirup (või mahl ja suhkur), limonaadi puhul on aga lahustunud veel ka süsihappegaas – see tekitabki limonaadis mulle.
Ehkki vesi on väga hea lahusti, ei lahustu selles siiski päris kõik ained. Näiteks ei lahustu vees kivi, liiv, metall, õli, rasv, bensiin. Kui keegi kasutas tunni alguse katses M&M’si komme, võis näha, et nende keskmine šokolaadiosa ei lahustunud. Šokolaadis on üsna palju rasva, rasv aga vees ei lahustu. Kui tahad salatikastet valmistades kokku segada õli ja veiniäädikat (mis on vesilahus), võid näha, et ka õli ei lahustu vees. Seda, millised ained vees lahustuvad ja millised mitte, uuritakse katsete tunnis.
5. Kartulikatse lõpetamine
10
- TV lk 5 ül 5 lõpetamine
Nüüdseks võiks olla eelmises tunnis riivitud kartul kuivanud ja katse saab lõpuni teha. Õpilastele võiks meelde tuletada, et katse uurimisküsimus oli, kui palju on kartulis vett. Lasta neil töövihikust oma hüpotees üle vaadata.
Õpetaja võiks klassi ette kutsuda mõne õpilase, kes aitaks kuivanud kartulipudi kaaluda. Õpilased kirjutavad tulemuse TV‑sse. Seejärel tuleb arvutada, mitme grammi võrra kartuli kaal vähenes. Saadud arv kujutab endast kartulist aurunud vee kogust. Kui suure osa kartuli algsest kaalust see moodustab, kas alla või üle poole? Mida saame järeldada? Saadud tulemuste analüüs ja püstitatud hüpoteesile hinnangu andmine (kas tulemused kinnitasid hüpoteesi või mitte) on väga oluline osa teaduslikust katsest.
See on ka koht, kus võib teadlasel tekkida uusi uurimisküsimusi (Kas kartulis on rohkem vett kui lillkapsas? Kas suur kartul koosneb sama suures koguses veest kui väike kartul?), millele vastuse leidmiseks tuleks teha uusi katseid. Ka tunnis tehtud katsete järel võiks ühiselt aru pidada, kuidas mingit katset muuta või täiendada saaks, milliseid uusi küsimusi õpilastel pärast katset tekkis ning kuidas võiks nendele vastuseid leida.
Kui mõni õpilane teeb ka kodus sama katset (kas kartuli või mõne muu köögiviljaga) ja on selle juba lõpetanud, võiks lasta tulemusi teistele tutvustada.
6. Kokkuvõte
7
- TV lk 7 ül 6 (Opiq ptk 1.2 ÜK „Tõene või vale väide?”)
- Tunni alguse katse ülevaatamine ja soovitusi koduseks katseks
Lahendage lk 7 ül 6 (ptk 1.2 ÜK „Tõene või vale väide?“).
Vastus.
- Väär. Hapnikku lisavad vette veetaimed.
- Väär. Rasvad ja õlid ei lahustu vees.
- Väär. Lahus koosneb lahustunud ainest ja lahustist.
- Väär. Vee molekul koosneb vesiniku ja hapniku aatomitest.
- Väär. Molekul on aineosake, mis koosneb vähemalt kahest aatomist.
Tunni lõpus võiks tunni alguses tehtud kommivikerkaare katse tulemused veel kord üle vaadata. Mis on tunni jooksul kommidega juhtunud? Mis värvi on vesi tunni lõpuks?
Õpetaja võiks julgustada õpilasi kodus katset kordama, kusjuures võiks muuta kommide paigutust, et saada erinevaid mustreid. Tulemused võiks pildistada ja õpetajale saata, et järgmiste tundide alguses oleks võimalik neid koos klassis vaadata. Võib ka kasutada erineva temperatuuriga vett (kas kommid lahustuvad kuumas vees kiiremini kui külmas?), teisi vedelikke (kas kommid lahustuvad ka toiduõlis samamoodi?) või teistsuguseid komme (kas kõik kommid lahustuvad ühtmoodi?).
Lisamaterjal
Noor teadlane Gitanjali Rao. Lisalugemine 2017. a Ameerika Ühendriikide noore teadlase konkursi võitnud 11‑aastasest tüdrukust ja tema leiutisest. Materjal sisaldab ka mõtlemisülesannet, milles õpilane peab sõnastama probleeme, mida ta tahaks muuta.
Asjade suuruse võrdluse simulatsioon. Vali simulatsiooni esilehel eesti keel. Seejärel lohista slaiderit paremale, et liikuda kaugemale, ja vasakule, et liikuda lähemale. Proovi skaalal üles leida inimese juuksekarva laius, veepiisk udus, punane verelible ja veemolekul. Objektil klõpsates saad selle kohta rohkem teada.
Osalemissoovitus
Õpilasleiutajate riiklikul konkursil võivad osaleda kõik õpilased eelkoolist kuni 12. klassi lõpuni.
Tunni kirjeldus ja kodutöö
Tunni kirjeldus
Õ ptk 1.2. Vesi kui aine. Vee omadused |
Harjutamine: TV lk 6 ül 1–3, lk 7 ül 6, lk 5 ül 5 (kartulikatse lõpetamine). Kommivikerkaare katse |